依據歐盟施行的個人資料保護法,我們致力於保護您的個人資料並提供您對個人資料的掌握。
按一下「全部接受」,代表您允許我們置放 Cookie 來提升您在本網站上的使用體驗、協助我們分析網站效能和使用狀況,以及讓我們投放相關聯的行銷內容。您可以在下方管理 Cookie 設定。 按一下「確認」即代表您同意採用目前的設定。
Latest News
中銀文摘
2021-04-29
化妝品、食品、藥物與醫療器材法律專區
台灣醫療器材管制政策——以醫療器材管理法為中心(下)
【中銀律師事務所 吳婕華合夥律師 / 楊明瑜律師】
charlotte.wu@zhongyinlawyer.com.tw
charlotte.wu@zhongyinlawyer.com.tw
接續上篇內容,2020年1月15日公布的醫療器材管理法象徵著我國醫療器材管制架構的革新,而這部法律將於2021年5月1日施行,在施行前,本文將鳥瞰本次修法內容、特色,以及相關的法規命令、行政規則等,對我國最新醫療器材管理政策做出概略式之分析。
醫療器材管理法之制定,係以管理的國際化、健全化以及專責化為核心。透過接軌國際間關於醫療器材管理的經驗,及產品生命週期與風險管理的角度,以單一法源統籌醫療器材管理制度,為此產業建立完整與健全,兼顧市場需求與病患權益之通盤管理架構。
承上述醫療器材管理制度的核心價值,此次醫療器材管理法共有以下特色:
一、業者業務適用範圍之擴張:
除傳統之醫療器材製造業,包含製造、包裝、貼標、滅菌或最終驗收,以及醫療器材販賣業,所謂經營醫療器材批發、零售、輸入、輸出、租賃之業者外,更擴展至醫療器材之「設計」及「維修」,依新法醫療器材設計業為醫療器材製造業者[1];而醫療器材維修業,則歸屬於醫療器材販賣業者[2]。而醫療器材商,依法皆應取得地方主管機關核准登記,領取許可執照後始得營業,如登記事項有變更時,亦應辦理變更登記[3]。
二、醫療器材產品製造、輸入、上市前與上市後之管理
(一) 醫療器材風險分級管理:原則上,醫療器材應進行查驗登記[4],經核發醫療器材許可證後始得製造與輸入,惟新法針對部分低風險之醫療器材,以登錄制取代登記制[5],而醫療器材商針對該低風險之醫療器材,應進行每年之年度申報以延續申報之有效性[6],既符合管理上之彈性,又能促進產業技術之創新。
(二) 特定醫療器材製造或輸入:具有預防、診治危及生命或嚴重失能之疾病,因醫療器材之輸入具有急迫性,故此次立法因應此種需求,亦增設例外規定[7],透過專案制度補充醫療器材管理之彈性。
(三) 上市後產品來源流向制度管理:醫療器材商及醫事機構針對中央主管機關公告一定風險等級之醫療器材,應建立與保存產品直接供應來源及流向之資料[8]。
(四) 醫療器材品質管理與運銷管理之系統建置:醫療器材製造業者應建立醫療器材品質管理系統,並符合中央主管機關訂定之品質管理系統準則[9]。就產品之儲存、運銷、服務、人員配置及其他相關作業事項,醫療器材販賣業者應符合中央主管機關所訂定之醫療器材優良運銷準則[10]。
(五) 上市後醫療器材安全監督管理:包含中央主管機關得指定品項、期間,令醫療器材依安全監視計畫監視醫療器材之安全性,醫療器材商並應定期製作安全監視報告繳交中央主管機關[11];如果醫療器材商或醫事機構發現醫療器材嚴重不良事件,也應通報中央主管機關[12]。醫療器材許可證所有人或登錄者發現醫療器材有危害人體健康之虞時,應即主動通報中央主管機關,並採取矯正預防措施[13]。
三、受試者權益之保障:
臨床試驗機構或試驗委託者發起醫療器材臨床試驗,應取得中央主管機關核准後始得為之。如臨床試驗之受試者於臨床試驗施行期間發生死亡、危及生命、暫時或永久性失能等重大不良事件等,臨床試驗機構及試驗委託者應通報中央主管機關。如中央主管機關認為醫療器材臨床試驗有危害人體健康之虞者,得令試驗之機構中止或終止試驗,或採取其他必要措施[14]。
除了本法之外,因應本法的規範細節,仍有許多授權中央主管機關訂定的法規命令與行政規則等,筆者彙整如下[15]:
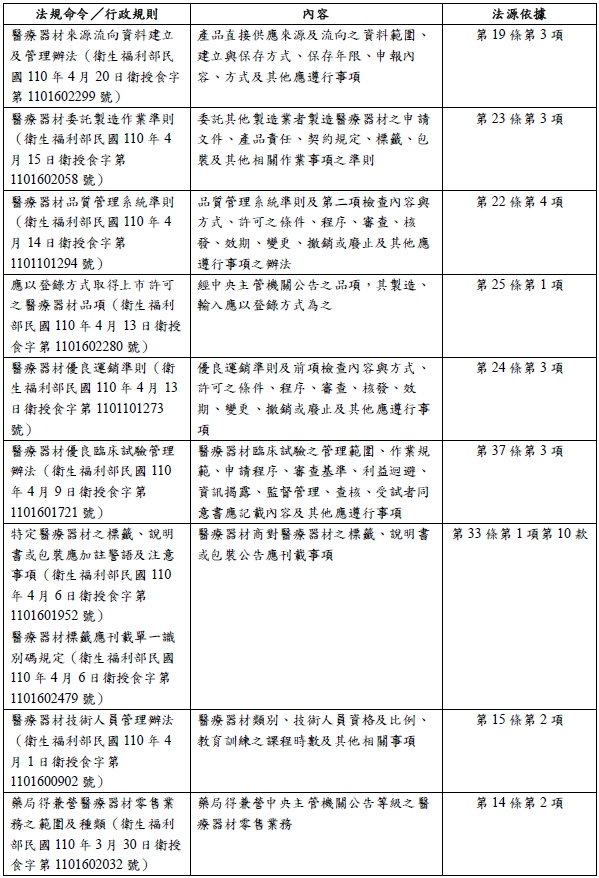
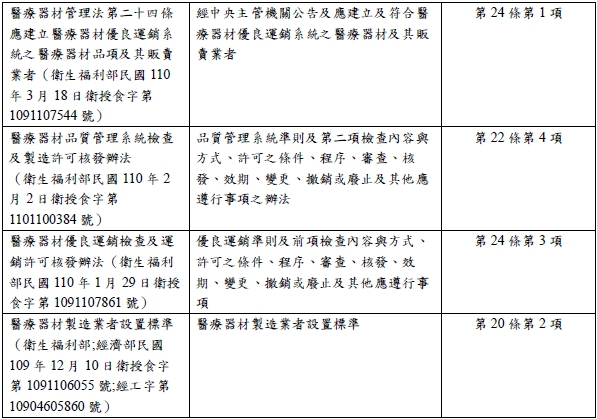
此次的立法,將醫療器材的管制獨立於藥事法之外,但細究法規架構,讀者仍能看出兩者並非有太大差異,但在品質控管、產品流向,以及擴大管制維修、設計業者之新規範,凸顯政府以貼近醫療器材產品生命週期為核心,建構更嚴密的規範密度。
有論者也指出,就創新的角度而言,軟體是否為醫療器材,此需要政府建置相當的指引提供業者參考,在美國的經驗中,依照醫療器材的風險在前端就做規範上的分流,除了在審查端減低壓力外,更能將資源使用在高風險之產品[16]。而針對具體之適用狀況及日後的挑戰,更考驗著政府、業者及病患等利害關係人,如何針對醫療產業發展隨之而來的挑戰,建構符合各方立場之制度。自前述彙整表格中,可以見得中央主管機關衛生福利部已完成建置部分醫療器材管理法之相關配套措施,但仍有許多相關法規尚處於預告草案階段[17],故在新法的施行下,仍建議業者應隨時注意最新的法規動態,以完成相關法遵要求。

如您對上述的內容有任何意見或有興趣進一步瞭解,歡迎您聯繫我們。
Charlotte J.H. Wu 吳婕華律師
charlotte.wu@zhongyinlawyer.com.tw
TEL +886 2 2377 1858 EXT 8888
[1] 鄒孟珍,2020,醫療器材管理法之規範與挑戰,月但醫事法報告,第44期,頁17-29。
[2] 例如:醫療器材許可證核發與登錄及年度申報準則(衛生福利部民國109年11月25日衛授食字第1091607599號)、特定醫療器材專案核准製造及輸入辦法(衛生福利部民國109年11月13日衛授食字第1091608817號)、應執行安全監視之醫療器材品項(衛生福利部民國109年11月6日衛授食字第1091609718號‘)醫療器材嚴重不良事件通報辦法(衛生福利部民國109年10月8日衛授食字第1091607972號)、輸入醫療器材邊境抽查檢驗辦法(衛生福利部民國109年11月19日衛授食字第1091609798號)、醫療器材回收處理辦法(衛生福利部民國109年11月6日衛授食字第1091609900號)醫療器材行政規費收費標準(衛生福利部民國109年8月18日衛授食字第1091605791號)、醫療器材檢驗委任或委託作業辦法(衛生福利部民國109年7月7日衛授食字第1091901027號)、醫療器材檢驗機構認證及委託認證管理辦法(衛生福利部民國109年4月1日衛授食字第1091101103號)、醫療器材管理事項委託及受託機構認證作業辦法(衛生福利部民國109年12月31日衛授食字第1091610074號)、醫療器材創新科技研究發展獎勵辦法(衛生福利部民國109年7月6日衛授食字第1091201055號)等。
[3] 醫療器材管理法第10條。
[4] 醫療器材管理法第11條。
[5] 醫療器材管理法第13條。
[6] 醫療器材管理法第25條。
[7] 同上註。
[8] 醫療器材管理法第28條。
[9] 醫療器材管理法第35條:「有下列情形之一者,中央主管機關得專案核准特定醫療器材之製造或輸入,不受第二十五條第一項規定之限制:
一、為預防、診治危及生命或嚴重失能之疾病,國內尚無合適替代療法。
二、因應緊急公共衛生情事之需要。
三、試驗用醫療器材。
四、專供樣品或贈品之用,或個人自用。
五、輸入專供維修,且修復後非於國內流通販賣。
六、依前條第四項公告為必要醫療器材之許可證產品,有無法繼續製造、輸入或不足供應之情形。前項專案核准之申請條件、審查程序、核准基準、供售限制、退運及其他應遵行事項之辦法,由中央主管機關定之。」
[10] 醫療器材管理法第19條。
[11] 醫療器材管理法第22條。
[12] 醫療器材管理法第24條。
[13] 醫療器材管理法第47條。
[14] 醫療器材管理法第48條。
[15] 醫療器材管理法第49條。
[16] 醫療器材管理法第37條至第39條。
[17] 彙整日期至2021年4月20日止。




